Мутация гена BRAF при меланоме
- Частота и виды мутаций в гене BRAF
- Механизм реализации канцерогенного потенциала. Влияние мутации на прогноз
- Статус мутации гена BRAF и выбор тактики лечения
Частота и виды мутаций в гене BRAF
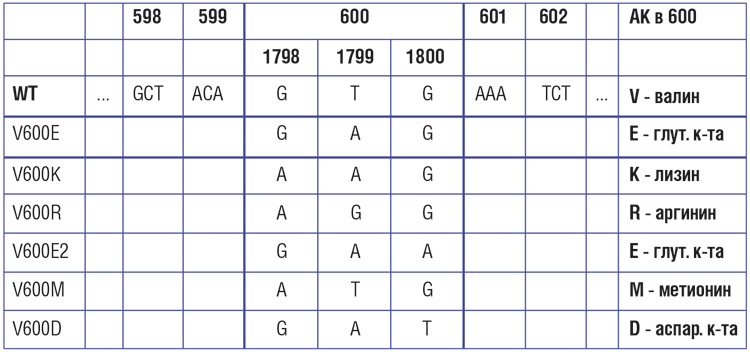
Частота мутаций в гене BRAF при меланоме кожи (МК), по данным разных исследователей, варьирует от 50% до 80%. Так, во всероссийском молекулярно-эпидемиологическом исследовании меланомы соматические мутации BRAF были выявлены в ~ 64% первичных опухолей с наибольшей распространенностью BRAF+ МК среди пациентов молодого и среднего возраста [4]. Наиболее частой (69-94% случаев) разновидностью BRAF-мутаций является V600E – замена валина на глутаминовую кислоту в 600-м кодоне. Эта мутация представляется доминирующей, но далеко не единственной разновидностью нарушений BRAF. Второй по частоте является мутация V600К – ее частота может достигать 5-10%. Мутации V600D и V600R встречаются значительно реже [1-3].
Механизм реализации канцерогенного потенциала. Влияние мутации на прогноз
Онкогенные мутации BRAF имитируют фосфорилирование активационной петли белка, что приводит к нахождению BRAF в постоянно активированном состоянии. Последующая работа MAPK сигнального пути в безостановочном режиме и потеря отрицательной обратной связи BRAF приводят к неконтролируемому росту и пролиферации клеток. Также для мутаций BRAF было установлено влияние на способность к тканевой инвазии. В связи с этим появление мутации BRAF рассматривается не только как событие, инициирующее неопластическую трансформацию, но и как способствующий дальнейшему прогрессированию механизм биологической адаптации опухолевой клетки [5,6].
Присутствие мутации в гене BRAF у пациентов с МК III/IV стадий ассоциировано с более низкими показателями общей (ОВ) и безрецидивной (БРВ) выживаемости. Данные наблюдательных и ретроспективных исследований указывают на более высокую частоту рецидивов среди пациентов с резецированной BRAF+ МК III-й стадии – 3-летняя частота рецидивов составила 77% против 54% у пациентов без мутации в гене BRAF (медиана БРВ 7 месяцев против 19 месяцев) [7,8].
Cтатус мутации гена BRAF и выбор тактики лечения
Открытие молекулярной мишени BRAF и понимание ее роли в патогенезе меланомы легли в основу разработки нового класса препаратов – низкомолекулярных ингибиторов мутированного фермента BRAF. Использование этих препаратов позволяет блокировать патологически активированный сигнальный каскад, который запускается мутацией BRAF V600, и, таким образом, тормозить развитие опухоли. Следует особо отметить, что воздействие данной группы препаратов на опухолевые клетки с нормальной последовательностью BRAF, напротив, может сопровождаться патологической активацией каскада RAS-RAF-MEK-ERK и провоцировать рост меланомы. Этот феномен свидетельствует об исключительной важности достоверной диагностики статуса гена BRAF.
BRAF ингибиторы не должны использоваться в тех случаях, когда статус мутации BRAF не определен или мутация не обнаружена!
В рандомизированных клинических исследованиях ингибиторы BRAF (иBRAF) –дабрафениб и вемурафениб – продемонстрировали значительное преимущество по сравнению со стандартной химиотерапией в отношении частоты объективных ответов, продолжительности жизни без прогрессирования и общей продолжительности жизни у пациентов с метастатической меланомой и подтвержденной мутацией гена BRAF, ранее не получавших системного лечения. Результаты последних исследований показали, что двойное ингибирование сигнального пути MAРK, которое достигается при одновременном использовании ингибиторов BRAF и MEK (иMEK), обладает более высокой эффективностью по сравнению с иBRAF в монорежиме. Важно отметить, что помимо более высокой эффективности комбинация препаратов снижает вероятность развития резистентности к проводимой терапии и отдельных нежелательных явлений, в том числе плоскоклеточного рака кожи.
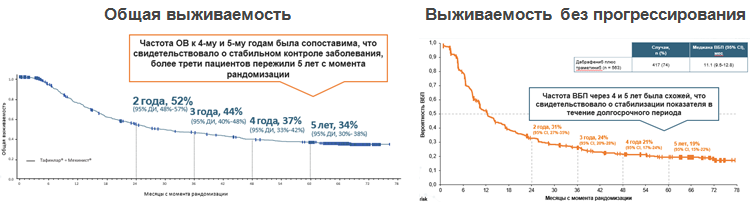
Введение в клиническую практику комбинации иBRAF и иMEK значительно улучшило результаты лечения пациентов с метастатической МК. Так, например, по данным исследований COMBI-d/v, где изучалась комбинация дабрафениба и траметиниба, 5-летняя ОВ составила 34% в общей популяции, включавшей пациентов с неблагоприятным прогнозом, получавших иBRAF/иMEK, а 5-летняя выживаемость без прогрессирования составила 19%, при этом наблюдался выход на плато через 4 года после начала терапии (см. рис.1) [9].
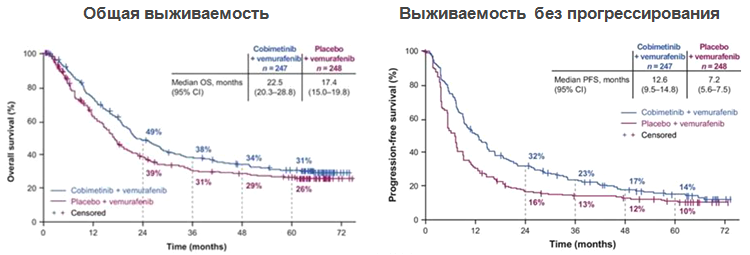
Схожие результаты были продемонстрированы и для комбинации вемурафениба с кобиметинибом. В рамках клинического исследования coBRIM было подтверждено, что комбинированная терапия с использованием препаратов вемурафениб и кобиметиниб в 90% случаев позволяет достичь ответа на терапию у больных BRAF+ метастатической меланомой. У каждого второго пациента более года отсутствовали признаки прогрессирования заболевания, а общая 5-летняя выживаемость составила 31% (см. рис. 2) [15].
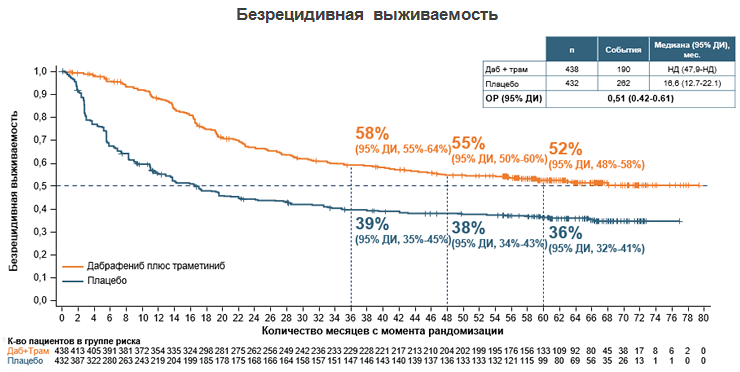
Впоследствии комбинация иBRAF/иMEK прошла валидацию в рандомизированном клиническом исследовании COMBI-AD, показавшем эффективность комбинации дабрафениба и траметиниба уже в адъювантном режиме лечения пациентов с МК III стадии после полной резекции опухоли. В исследовании COMBI-AD было показано, что применение комбинации дабрафениба и траметиниба у больных BRAF+ МК III-й стадии позволяет снизить риск возникновения рецидива через 5 лет после начала лечения на 49% (см. рис.3) [10].
Рисунок 1. Результаты рандомизированного исследования COMBI-d/v: эффективность комбинации дабрафениба и траметиниба в 1-й линии терапии метастатической меланомы кожи с мутацией в гене BRAF.
Рисунок 2. Результаты рандомизированного исследования coBRIM: сравнение эффективности комбинации вемурафениба+кобиметиниба и плацебо+вемурафениба в 1-й линии терапии метастатической меланомы кожи с мутацией в гене BRAF.
Рисунок 3. Результаты рандомизированного исследования COMBI-AD: сравнение эффективности комбинации дабрафениба+траметиниба и плацебо в адъювантной терапии меланомы кожи с мутацией в гене BRAF.
На сегодняшний день таргетная терапия иBRAF и иMEK входит во все международные и национальные клинические рекомендации, в современные стандарты лечения метастатической меланомы кожи с BRAF мутацией. Комбинация дабрафениб+траметиниб также рекомендована в адъювантном режиме пациентам с III стадией МК, перенесшим радикальное удаление первичной меланомы [11-14].
Таким образом, тестирование пациентов с МК на предмет наличия или отсутствия мутации в гене BRAF является необходимым не только для оценки индивидуального прогноза пациента, но и выбора наиболее эффективной тактики дальнейшего лечения в случаях местнораспространенной и метастатической МК.
В связи с этим рекомендации ESMO и NCCN указывают на необходимость обязательного тестирования на BRAF-мутацию пациентов с МК III/IV стадий, а также желательно для пациентов высокого риска IIC стадии [11,12].
В клинических рекомендациях Ассоциации онкологов России (АОР) и RUSSCO утверждено обязательное проведение молекулярно-генетического исследования (МГИ) мутаций в гене BRAF всем пациентам с МК в биопсийном материале (или ранее удаленных лимфатических узлов, или первичной опухоли), начиная с III-й стадии [13,14].
Появляются результаты исследований таргетных препаратов и при других типах меланомы, имеющих альтернативные мутации (NRAS, cKIT). Можно ожидать, что определение молекулярно-генетического портрета опухоли уже в ближайшее время станет неотъемлемой частью разработки стратегии лечения каждого пациента, имеющего диагноз «меланома».
Статьи:
- Davies H, et al. Mutations of the BRAF gene in human cancer. Nature. 2002; Vol. 417, №6892, P.949-954.
- Spathis A, et al. BRAF mutation status in primary, recurrent, and metastatic malignant melanoma and its relation to histopathological parameters. Dermatology practical & conceptual. 2019; Vol.9, №1, P.54.
- Soltani M, et al. Genetic study of the BRAF gene reveals new variants and high frequency of the V600E mutation among Iranian ameloblastoma patients. Journal of Oral Pathology & Medicine. 2018; Vol. 47, №1, P. 86-90.
- Франк Г.А. и др. Первое Всероссийское молекулярно-эпидемиологическое исследование меланомы: результаты анализа мутаций в гене BRAF. Архив патологии. 2014; Т.3, С.65-73.
- Sullivan R, LoRusso P, Boerner S, Dummer R. Achievements and challenges of molecular targeted therapy in melanoma. Am Soc Clin Oncol Educ Book. 2015; P.177-186.
- Czarnecka AM, Bartnik E, Fiedorowicz M, Rutkowski P. Targeted Therapy in Melanoma and Mechanisms of Resistance. Int J Mol Sci. 2020; 21(13): 4576.
- Barbour AP, Tang YH, Armour N, et al. BRAF mutation status is an independent prognostic factor for resected stage IIIB and IIIC melanoma: implications for melanoma staging and adjuvant therapy. Eur J Cancer. 2014; 50(15): 2668-2676.
- Ekedahl H, Cirenajwis H, Harbst K, et al. The clinical significance of BRAF and NRAS mutations in a clinic-based metastatic melanoma cohort. Br J Dermatol. 2013; 169(5): 1049-1055.
- Robert C, et al. Five-year outcomes with dabrafenib plus trametinib in metastatic melanoma. New England Journal of Medicine. 2019; Vol.381, №7, P.626-636.
- Long GV, et al. Adjuvant dabrafenib plus trametinib in stage III BRAF-mutated melanoma. New England Journal of Medicine. 2017; Vol.377. №19, P.1813-1823.
- Michielin O, van Akkooi ACJ, Ascierto PA, Dummer R, Keilholz U; ESMO Guidelines Committee. Cutaneous melanoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2019; 30(12): 1884-1901.
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Melanoma. Version 2.2021.
- Строяковский Д.Л., Абрамов М.Е., Демидов Л.В., Жукова Н.В., Новик А.В., Орлова К.В. и соавт. Практические рекомендации по лекарственному лечению меланомы кожи. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10); 16.
- Практические рекомендации Ассоциации онкологов России, Министерство здравоохранения Российской Федерации. Меланома кожи и слизистых оболочек, 2020.
- Ascierto PA, et al. 5-Year Outcomes with Cobimetinib plus Vemurafenib in BRAFV600 Mutation-Positive Advanced Melanoma: Extended Follow-up of the coBRIM Study. Clinical Cancer Research. 2021; Vol.27, №19, P.5225-5235.
Войти
в базу данных
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
в программе
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.