Мутации гена PIK3CA
- PI3K-зависимый молекулярный каскад в патогенезе ГР+ HER2- РМЖ
- Частота встречаемости мутации гена PIK3CA в ГР+ HER2- распространенном РМЖ
- Определение мутации гена PIK3CA
- Прогностическая и предиктивная роль мутации гена PIK3CA
- О программе определения мутации гена PIK3CA у пациентов с диагнозом ГР+ HER2- рРМЖ
Тестирование на наличие мутации гена PIK3CA в рамках программы «Совершенствование молекулярно-генетической диагностики в Российской Федерации» выполняется в целях определения прогноза у пациентов c диагнозом распространенный или метастатический ГР+ HER2- рак молочной железы (IIIB-IV стадии).
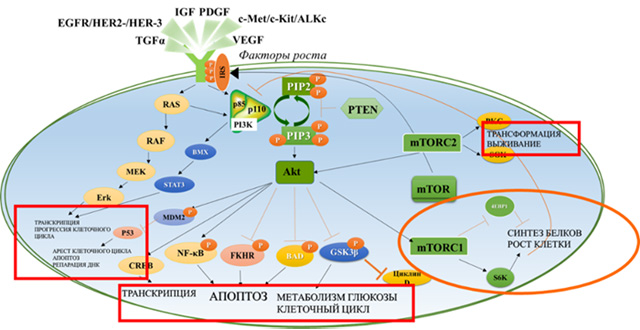
PI3K-зависимый молекулярный каскад в патогенезе ГР+ HER2- РМЖ
Эндокринная терапия (ЭТ) является основной опцией для лечения пациентов с гормонозависимыми подтипами РМЖ. Клиническую пользу от применения препаратов, контролирующих продукцию эстрогена и/или прогестерона, получают ≈50% больных с ГР+ HER2- рРМЖ [1].
Развитие резистентности к ЭТ обусловлено взаимодействием множества молекулярных каскадов, вовлеченных в процессы роста и развития опухоли [1]. Так, нарушение регуляции сигнального каскада PI3K-Akt-mTOR наблюдается в более 70% случаев РМЖ. Одной из причин патологической активации сигнального пути PI3K-Akt-mTOR является мутация гена PIK3CA (PIK3CA+), кодирующего фосфатидил-инозитол-3-киназу (PI3K).
Частота встречаемости мутации гена PIK3CA в ГР+ HER2- распространенном РМЖ
Мутации гена PIK3CA (PIK3CA+) распространена в 40% случаев ГР+ HER2- рРМЖ и определяет резистентность опухоли к ЭТ [2].
Адаптировано на основании: 1. Miller TW, et al. J Clin Oncol. 2011; 29(33):4452-4461. 2. Bosch A, et al. Sci Transl Med. 2015; 7(283):283ra51. 3. Mayer IA, et al. Clin Cancer Res. 2017; 23(1):26-34. 4. Loi S, et al. Proc Natl Acad Sci U S A. 2010; 107(22):10208-10213. 5. Stemke-Hale K, et al. Cancer Res. 2008; 68(15):6084-6091. 6. Miller TW, et al. J Clin Invest. 2010; 120(7):2406-2413. 7. Crowder RJ, et al. Cancer Res. 2009; 69(9):3955-3962. 8. Miller TW, et al. Cancer Discovery. 2011; 1(4):338-351; 9. Vogt PK, et al., Cancer Discov. 2011 Nov; 1(6):481-486. 10. Saran U, et al. Clin Sci (Lond). 2015 Nov; 129(10):895-914. doi: 10.1042/CS20150149.
Определение мутации гена PIK3CA
Большинство мутаций гена PIK3CA локализованы в определенных областях экзонов 9 и 20 [3].
Соматические мутации гена PIK3CA в раке молочной железы
Экзон 20 кодирует каталитический домен р110α, и мутации в этом домене гена PIK3CA могут прямо стимулировать конститутивную ферментативную активность PI3K. Экзон 9 кодирует хеликазный домен р110α, и мутация в этом домене подавляют ингибирующее взаимодействие N-концевого участка р85 с р110α. Часть более редких мутаций обнаружена в домене, кодирующем N-концевой участок р110α, взаимодействующий с р85. И такой тип мутаций усиливает липидную активность PI3K, но не влияет на образование комплекса р85α – р110α [3].
В опухолевых клетках РМЖ определен спектр наиболее характерных изменений в гене PIK3CA, определяющий патологическую активацию каскада PI3K-Akt-mTOR. Высокая частота миссенс-мутаций в 9 и 20 экзонах соответствует аминокислотам E542K и E545K в экзоне 9 хеликазного домена; в экзоне 20 киназного домена – H1047R и H1047L; наиболее частая мутация для люминального А подтипа РМЖ – E545K [4,5].
Прогностическая и предиктивная роль мутации гена PIK3CA
Появление мутаций гена PIK3CA в канцерогенезе ассоциировано с повышением степени злокачественности опухоли (отсутствие мутаций при G1 в сравнении с 20% при G3) и достоверно снижает безрецидивную выживаемость в общей группе пациентов с диагнозом РМЖ III стадии в сравнении с пациентами без мутации и (p<0,05):
- 1-летняя выживаемость была снижена на 20%;
- 2-летняя – на 30%;
- 3-летняя – на 50%;
- 5-летняя – на 30%.
Медиана 5-летней безрецидивной выживаемости пациентов с PIK3CA диким типом не была достигнута, в то время как у пациентов с PIK3CA+ составила 35,8 месяца [6].
В мета-анализе 2018 года, целью которого было определить клинический прогноз у больных распространенным ГР+ HER2- РМЖ в популяциях с мутациями/без мутаций гена PIK3CA, было доказано, что пациенты с PIK3CA+ опухолями, получавшие терапию, не содержащую ингибиторы PI3K*, характеризовались более низкими показателями мВБП в сравнении с пациентами PIK3CA дикого типа. И наоборот, больные с мутациями гена PIK3CA, получившие таргетную терапию ингибиторами PI3K, достигли более высоких показателей эффективности лечения, чем пациенты без мутации [7].
Неблагоприятная прогностическая роль мутации гена PIK3CA была подтверждена в рамках подгрупповых анализов рандомизированных клинических исследований по изучению ингибиторов CDK4/6 и mTOR: пациенты с мутацией гена PIK3CA характеризовались более низкими показателями эффективности терапии по сравнению с пациентами без мутации [8-10].
Тестирование на мутацию гена PIK3CA помогает разработать соответствующую стратегию лечения для пациентов с ГР+ HER2- рРМЖ.
* Моно-ЭТ: фулвестрант, летрозол, экземестан. Таргетная терапия не ингибиторами PI3K: ингибиторы mTOR, ингибиторы CDK4/6 (палбоциклиб или рибоциклиб).
О программе определения мутации гена PIK3CA у пациентов с диагнозом ГР+ HER2- рРМЖ
- Тестирование в рамках программы проводится на всей территории страны.
- Отправка материала и тестирование проводятся бесплатно для врачей, лечебных учреждений и пациентов. В рамках программы возможна отправка опухолевой ткани (гистологического блока и обязательно стекол от этого блока, окрашенных гематоксилином/эозином).
Список цитируемой литературы:
- AlFakeeh A & Brezden-Masley C. Overcoming endocrine resistance in hormone receptor-positive breast cancer. Curr Oncol. 2018 Jun; 25(Suppl 1): S18-S27.
- Juric D, Ciruelos EM, Rubovszky G, et al. Alpelisib (ALP) + fulvestrant (FUL) for advanced breast cancer (ABC): Phase 3 SOLAR-1 trial results. Presented at: 2018 San Antonio Breast Cancer Symposium; December 4-8, 2018; San Antonio, Texas. Abstract GS3-08.
- Liu W, et al. PIK3CA Mutations May Be Discordant between Primary and Corresponding Metastatic Disease in Breast Cancer. Clin. Cancer Res. 2010. Vol.17, no.4, P.667-677.
- Dogruluk T, et al. Identification of Variant-Specific Functions of PIK3CA by Rapid Phenotyping of Rare Mutations. Cancer Res. Dec. 2015. Vol.75, no.24, P.5341-5354.
- Kalinsky K, et al. PIK3CA Mutation Associates with Improved Outcome in Breast Cancer. Clin. Cancer Res. Aug. 2009. Vol.15, no.16, P.5049-5059.
- Filipenko ML, et al. Association between the Prevalence of Somatic Mutations in PIK3CA Gene in Tumors and Clinical and Morphological Characteristics of Breast Cancer Patients. Bull. Exp. Biol. Med. 2017. Vol.163, no.2, P.250-254.
- Anderson EJ, et al. A systematic literature review of the clinical prognosis of HR+/HER2- advanced or metastatic breast cancer with and without PIK3CA mutation. J. Clin. Oncol. May 2018. Vol.36, no.15_suppl, e13037-e13037.
- Hortobagyi GN, et al. Correlation of molecular alterations with efficacy of everolimus in hormone receptor-positive, HER2-negative advanced breast cancer: Results from BOLERO-2. J. Clin. Oncol. Jun. 2013. Vol.31, no.18_suppl, LBA509-LBA509.
- Neven P, et al. 346PRibociclib (RIB) + fulvestrant (FUL) in hormone receptor-positive (HR+), human epidermal growth factor receptor 2-negative (HER2-) advanced breast cancer (ABC): MONALEESA-3 biomarker analyses. Ann. Oncol. Oct. 2018. Vol.29, suppl_8.
- Huang X, et al. Early circulating tumor DNA dynamics and clonal selection with palbociclib and fulvestrant for breast cancer. Nat. Commun. 2018. Vol.9, no.1, P.1-10.
Войти
в базу данных
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
в программе
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.