Мутации генов семейства RAS
- Сигнальный путь EGFR и мутации генов семейства RAS при колоректальном раке
- Сигнальный путь RAS
- Роль белка RAS в сигнальном пути EGFR
- Нарушение систем передачи сигнала и канцерогенез
- Точечные мутации онкогенов RAS при мКРР
- Значение различных мутаций RAS
- Возрастающая роль сигнального пути RAS в индивидуализированной терапии мКРР
Сигнальный путь EGFR и мутации генов семейства RAS при колоректальном раке
Постоянная активация сигнального каскада рецептора эпидермального фактора роста (EGFR) является одной из ведущих причин опухолевой трансформации и прогрессии.
Причинами подобной активации могут быть:
- Увеличение количества молекул рецептора на мембране клеток.
- Мутации в структуре рецептора, позволяющие ему генерировать сигнал без участия лиганда.
- Мутации других генов-участников каскада, способных активировать его вне зависимости от статуса EGFR.
Для колоректального рака характерны 1 и 3 пути активации.
Блокада сигнального каскада EGFR с помощью моноклональных антител, связывающихся с рецептором, показала высокую клиническую эффективность при целом ряде опухолей, в том числе при колоректальном раке. Однако использование этих препаратов в неселектированной группе больных приводило к ответу на лечение лишь у 25% пациентов.
Первоначальный молекулярный анализ образцов пациентов, участвовавших в исследованиях OPUS и CRYSTAL, показал, что существенную роль в резистентности опухоли к терапии моноклональными антителами играют мутации гена KRAS, одного из участников внутриклеточной части сигнального каскада EGFR.
Однако дальнейшие исследования показали, что не меньшее значение в определении полноты противоопухолевого ответа играют и другие участники сигнального пути, начинающегося с рецептора EGFR: гены RAS-RAF-MEK-ERK-МАРК.
Сигнальный путь RAS
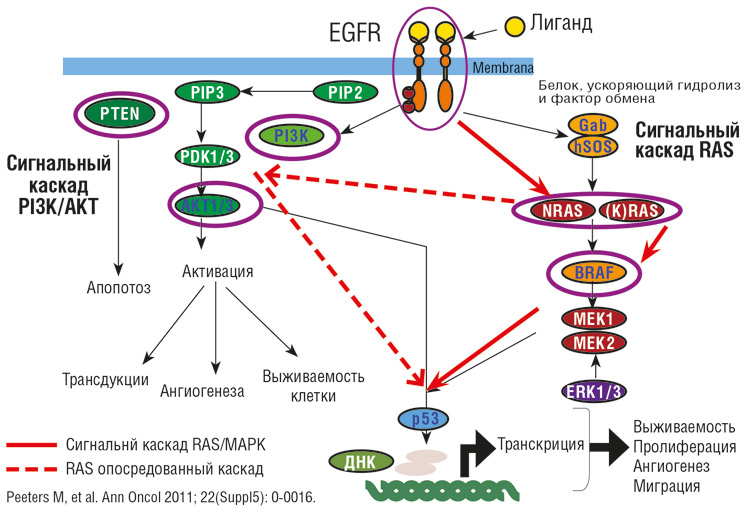
В RAS-зависимом сигнальном пути ключевую роль играют белки семейства RAS. Фиксированные на внутренней стороне клеточной мембраны, белки RAS являются первыми членами каскада киназ, которые приводят к активации сигнальных путей и транскрипции генов, регулирующих дифференцировку и пролиферацию клетки.
Роль белка RAS в сигнальном пути EGFR
Семейство генов RAS (Retrovirus Associated DNA Sequences) включает 3 гена: KRAS, HRAS, NRAS. Первые два гена получили название от своих гомологов, выделенных из линий вирусов мышиной саркомы Kirsten и Harvey, последний был идентифицирован в клеточной линии нейробластомы. Три гена кодируют четыре варианта протеинов – два типа KRAS, А и В (наиболее часто распространенный), и по одному типу HRAS и NRAS.4 Все они относятся к белкам, связывающим энергетическую молекулу ГТФ. RAS-белки могут существовать в двух формах: неактивной, GDP- и активной, GTP-связанной. Благодаря собственной GTP-азной активности, а также под действием факторов обмена (Sos и др.), белок RAS циклически переходит из GTP-связанной активной формы в GDP-связанную неактивную и обратно.
Нормальный RAS находится преимущественно в неактивной, GDP-связанной форме. Активация RAS регулируется рецепторной тирозинкиназой EGFR. После связывания рецепторной внеклеточной части тирозинкиназы с фактором роста и ее димеризации происходит взаимное фосфорилирование ее внутриклеточных доменов. Фосфорилирование создает активную конформацию киназы. Образование активного комплекса RAS-GTP происходит в присутствии активирующего GTP-азу белка GAP, в сотни раз ускоряющего гидролиз. После гидролитического превращения GTP в GDP RAS снова инактивируется. Сигнал прерывается. Чтобы воспринять новый сигнал, если он еще существует вне клетки, цикл реактивации должен быть повторен.
Таким образом, каскадная последовательность реакций сигнального пути RAS действует как включатель, определяющий регуляцию генной экспрессии, требующуюся для реализации деления или дифференцировки клетки.
Нарушение систем передачи сигнала и канцерогенез
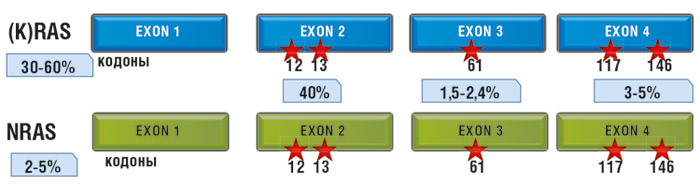
RAS-белки часто упоминают как протоонкогенные продукты: их постоянная активация ведет к злокачественному перерождению клеток. Характерный механизм перерождения RAS – точечные мутации в соответствующих генах. Наиболее частыми онкогенными мутациями генов всего семейства RAS являются мутации в 12 и 61 кодонах.
Мутации в гене KRAS в опухолях толстой кишки встречаются в 30-60% случаев. Наиболее часто мутации KRAS определяются в экзоне 2, кодонах 12 и 13. Однако описаны мутации в экзоне 3, кодоне 61, и в экзоне 4, кодонах 117 и 146. Мутации в гене NRAS (в идентичных экзонах и кодонах) при КРР составляют до 5%. Мутации в гене HRAS при аденокарциноме толстой кишки не описаны.
Мутации генов семейства RAS при злокачественных опухолях
(по базе данных COSMIC)
| Орган | Тип опухоли | Мутации (%) | ||
|---|---|---|---|---|
| HRAS | KRAS | NRAS | ||
| Колоректальный рак | Аденокарцинома | 0 | 42 | 5 |
| Желчные пути | Аденокарцинома | 0 | 35 | 2 |
| Мочевой пузырь | Уротелиальная карцинома | 12 | 4 | 2 |
| Печень | Гепатоцеллюлярный рак | 0 | 4 | 4 |
| Легкое | Крупноклеточный рак | 4 | 21 | 4 |
| Аденокарцинома | 0 | 16 | 1 | |
| Поджелудочная железа | Протоковая аденокарцинома | 0 | 69 | 1 |
| Эндокринные опухоли | 0 | 1 | 75 | |
| Кожа | Меланома | 1 | 2 | 20 |
Точечные мутации онкогенов RAS при мКРР
Значение различных мутаций RAS
Как уже говорилось выше, при колоректальном раке почти 90% всех нарушений представляют собой точечные замены одного нуклеотида на другой во втором экзоне генов KRAS и NRAS, в последовательностях, кодирующих 12 и 13 аминокислоты. В норме в обеих позициях располагается глицин, единственная аминокислота, не имеющая боковой цепи. Любое изменение этой последовательности приводит к замене глицина на разветвленные аминокислоты, что ведет к нарушению пространственной конформации протеина. В результате этого блокируется способность специальных белков инактивировать комплекс RAS с ГТФ путем гидролиза энергетической молекулы. Сигнал начинает передаваться от активированного RAS к другим участникам каскада независимо от статуса EGFR.
Около 10% мутаций этой гена в колоректальных опухолях происходят в 3 и 4 экзонах, с одинаковой частотой в 61 и 146 кодонах и крайне редко – в 117 кодоне. Мутации, затрагивающие 61 кодон, нарушают водородные связи между RAS и белками-инактиваторами, приводя к тому же эффекту, что и при нарушениях в 12 и 13 кодонах гена. Мутации 146 кодона не сопровождаются существенными изменениями активности протеина.
Тем не менее, эти мутации оказывают свое негативное воздействие в результате накопления дефектного белка на фоне аллельного дисбаланса – увеличения копийности мутантного гена или перехода его в гомозиготное состояние, что весьма характерно для опухолей с мутациями генов семейства RAS.
Возрастающая роль сигнального пути RAS в индивидуализированной терапии мКРР
Самым известным биомаркером в таргетной анти-EGFR терапии пациентов c мКРР является статус мутаций кодонов 12 и 13 гена KRAS. Доказано, что активация KRAS за счет мутации сводит на нет эффект ингибирования EGFR моноклональными антителами. Таким образом, наличие мутантных аллелей гена KRAS является независимым предсказательным маркером эффективности терапии ингибиторами EGFR. Поэтому панитумумаб и цетуксимаб назначают только больным мКРР с диким типом гена KRAS.
Влияние дополнительных мутаций гена KRAS и новых мутаций гена NRAS, а также мутаций гена BRAF на эффективность таргетной терапии ингибиторами EGFR изучалось в исследованиях с панитумумабом и цетуксимабом пациентов мКРР:
- Анализ мутаций генов KRAS/NRAS и мутации гена BRAF в исследовании 3 фазы PRIME: комбинации панитумумаб+FOLFOX4 в сравнении с FOLFOX4 в 1-й линии терапии метастатического колоректального рака
Oliner K, Douillard JY, Siena S, et al. Analysis of KRAS/NRAS and BRAF mutations in the phase III PRIME study of panitumumab (pmab) plus FOLFOX versus FOLFOX as first-line treatment (tx) for metastatic colorectal cancer (mCRC). ASCO 2013 (poster discussion): 3511 - Анализ мутаций генов RAS/RAF в исследовании 2 фазы PEAK: комбинации панитумумаба с mFOLFOX6 в сравнении с бевацизумабом в комбинации с mFOLFOX6 в 1-й линии терапии пациентов с метастатическим колоректальным раком с WTKRAS
Schwartzberg LS, Rivera F, Karthaus M, et al. PEAK (study 20070509): A randomized phase II study of mFOLFOX6 with either panitumumab (pmab) or bevacizumab (bev) as first-line (tx) in patients (pts) with unresectable wild type (WT) KRAS metastatic colorectal cancer (mCRC). J Clin Oncol 2013; 30 (Suppl 34): 446 - Анализ влияния мутаций генов семейства RAS (2 экзона KRAS и других RAS-мутаций) в исследовании CRYSTAL: комбинации цетукпсимаба с FOLFIRI в сравнении с FOLFIRI в 1-й линии терапии пациентов с метастатическим колоректальным раком на выживаемость пациентов без прогрессии и общую выживаемость
Van Cutsem et al. Fluorouracil, leucovorin, and irinotecan plus cetuximab treatment and RAS mutations in colorectal cancer. J Clin Oncol. 2015 Mar 1; 33(7): 692-700
Все исследования показали, что, несмотря на то, что индивидуализация терапии антителами по статусу генов семейства RAS предусматривает сужение круга пациентов (примерно 50/50 вместо 60/40 при отборе только лишь по статусу 2 экзона гена KRAS), пациенты с диким типом генов KRAS и NRAS в опухоли получат максимальную пользу от терапии антителами в комбинации со стандартной химиотерапией, по сравнению с пациентами без мутаций гена KRAS во 2 экзоне. Пока нет достаточных доказательств негативного влияния мутаций генов BRAF, PI3K, PTEN и других участников сигнального пути RAS-RAF-MEK-ERK-МАРК по результатам крупных проспективных рандомизированных исследований, однако не исключено, что появление таких исследований вновь существенно изменит наши представления о группе пациентов, для которых применение анти-EGFR антител окажется наиболее выгодным.
В связи с этим целью программы является максимально широкое внедрение генетического тестирования при колоректальном раке в ежедневную практику онкологов, как одного из важнейших условий проведения современной эффективной терапии у целевой группы пациентов.
Список литературы:
- Heldin CH. Dimerization of cell surface receptors in signal transduction. Cell 1995; vol.80, no.2, pp.213-223.
- Carpenterand G, Cohen S. Epidermal growth factor. J Biol Chem, 1990; vol.265, no.14, pp.7709-7712.
- Citri A, Yarden Y. EGF-ERBB signalling: towards the systems level. Nature Rev Molecular Cell Biol 2006; vol.7, no.7, pp.505-516.
- Boguski MS, McCormick F. Proteins regulating Ras and its relatives. Nature 1993; 366: 643-654.
- Vakiani E, Solit DB. KRAS and BRAF: drug targets and predictive biomarkers. J Pathol 2011; 223: 219-229.
- Edkins S, O’Meara S, Parker A, et al. Recurrent KRAS codon 146 mutations in human colorectal cancer. Cancer Biol Ther 2006; 5: 928-932.
- Janakiraman M, Vakiani E, Zeng Z, et al. Genomic and biological characterization of exon 4 KRAS mutations in human cancer. Cancer Res 2010; 70: 5901-5911.
- Soh J, Okumura N, Lockwood WW, et al. Oncogene mutations, copy number gains and mutant allele specific imbalance (MASI) frequently occur together in tumor cells. PLoS One. 2009, 14, no.4(10). P.7464.
Войти
в базу данных
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
в программе
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.