Диагностика экспрессии PD-L1
- Что представляет собой лиганд рецептора программируемой клеточной гибели (PD-L1)?
- Роль PD-L1 в патогенезе злокачественных образований
- Что нужно учитывать при выборе теста для оценки PD-L1 экспрессии?
- Каким пациентам необходимо определение уровня PD-L1 экспрессии?
- НМРЛ: методы определения экспрессии PD-L1
- УРОТЕЛИАЛЬНЫЙ РАК: методы определения экспрессии PD-L1
- Какой метод используется для определения экспрессии PD-L1 у пациентов с уротелиальным раком?
- Какой уровень PD-L1 экспрессии является основанием для назначения иммуннотерапии при уротелиальном раке?
- ТНРМЖ: методы определения экспрессии PD-L1
- Какой метод используется для определения экспрессии PD-L1 у пациентов с ТНРМЖ?
- Какой уровень PD-L1 экспрессии является основанием для назначения иммунной терапии при ТНРМЖ?
- О программе определения экспрессии PD-L1
- Правила отправки биообразцов на PD-L1 исследование
Что представляет собой лиганд программируемой клеточной гибели PD-L1?
- PD-L1 – трансмембранный белок, лиганд к рецептору PD-1. При связывании с рецептором PD-1 на цитотоксических лимфоцитах блокирует их цитотоксическую активность
- В норме участвует в физиологическом механизме подавления аутоиммунных реакций
- При экспрессии PD-L1 опухолевыми клетками данный лиганд участвует в механизмах ускользания опухоли от иммунного контроля (рис.1)
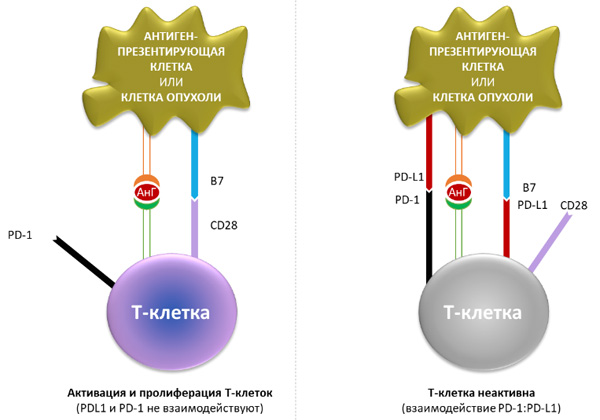
PD-L1 – лиганд рецептора программируемой клеточной гибели 1 (PD-1). Это трансмембранный белок с молекулярной массой 40 кДа, экспрессируемый на T- и B-лимфоцитах, NK-клетках, дендритных клетках, макрофагах, мезенхимальных стволовых клетках. PD-L1 способен связываться не только с рецептором PD-1, но и обладает сродством к CD80 (B 7.1) – белку, находящемуся на поверхности дендритных клеток, активированных B-клеток и моноцитов, который стимулирует активацию и выживаемость Т-лимфоцитов путем взаимодействия с CD28 на их поверхности. Лиганд PD-L1 способен угнетать этот процесс путем конкурентного связывания с CD80. На рисунке 1 представлены межклеточные взаимодействия (активирующие и ингибирующие сигналы) между Т-лимфоцитом и антигенпрезентирующей клеткой.
Рисунок 1. PD-1/PD-L1 сигнальный каскад в межклеточном взаимодействии иммунокомпетентных клеток. При связывании лиганда PD-L1 (лиганд рецептора программируемой клеточной смерти 1, также называемого PD-1) с рецепторами PD-1 и B7.1, находящимися на Т-лимфоцитах, происходит угнетение цитотоксической активности Т-лимфоцитов.
Роль PD-L1 в патогенезе злокачественных образований
Воздействие на сигнальный путь иммунной контрольной точки PD-1:PD-L1 лежит в основе иммунной терапии рака легкого, молочной железы, уротелиального рака и других злокачественных новообразований. Воздействие направлено на рецептор PD-1 и его лиганды PD-L1 и PD-L2. Наиболее важная роль в ускользании опухоли от иммунного ответа отводится взаимодействию рецептора PD-1 и лиганда PD-L1.
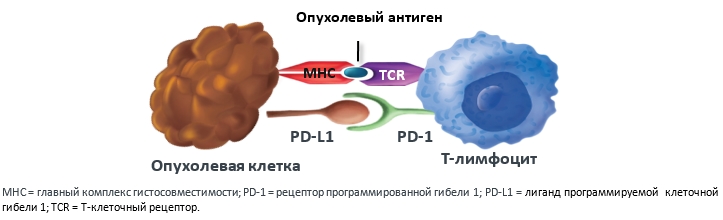
Длительная антигенная стимуляция, часто наблюдаемая при опухолевых заболеваниях, приводит к устойчивой экспрессии рецептора PD-1 на T-лимфоцитах и повышению экспрессии лигандов PD-L1 на опухолевых и иммунных клетках. Таким образом, опухоль вырабатывает механизм ускользания от иммунного ответа посредством гиперэкспрессии лиганда PD-L1, который, связываясь с рецептором PD-1 на T-лимфоцитах, нарушает их цитотоксическую активность (рис.2).
Рисунок 2. Сигнальный путь PD-1:PD-L1, инактивирующий действие Т-лимфоцитов.
Что нужно учитывать при выборе теста для оценки PD-L1 экспрессии?
Тест для определения экспрессии PD-L1 позволяет выделить группу пациентов с наибольшей вероятностью ответа на терапию ингибиторами иммунных контрольных точек. Важно учитывать, что для различных иммунных препаратов и показаний существуют отличия в методике проведения PD-L1 тестирования:
- Отличается пороговый уровень PD-L1 экспрессии. Для одного препарата порог назначения – это 1% экспрессии PD-L1 и более, для другого – это уровень не менее 5%.
- Отличается тип клеток, на которых оценивается PD-L1. Некоторые опухоли требуют исследования уровня PD-L1 на опухолевых клетках, другие – на иммунных.
- Отличаются тест-системы для PD-L1. Так, для определения PD-L1 при тройном негативном раке молочной железы перед назначением анти-PD-L1 терапии проводится исследование PD-L1 c применением тест-системы Ventana SP142. Важно учитывать, что в случае изменения терапии может потребоваться другая тест-система – тест SP263 или 22С3.
Вывод – перед проведением PD-L1 исследования необходимо удостовериться, что выбран правильный тест, на правильной культуре клеток и корректно интерпретировать полученные результаты.
Каким пациентам необходимо определение уровня PD-L1 экспрессии?
Анализ экспрессии PD-L1 в зависимости от планируемой к назначению терапии может быть рекомендован к назначению пациентам с:
- метастатическим НМРЛ (плоскоклеточным и неплоскоклеточным);
- распространенным уротелиальным раком;
- метастатическим тройным негативным раком молочной железы.
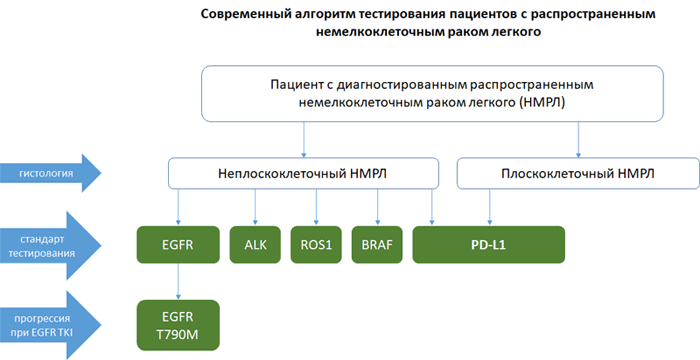
НМРЛ: методы определения экспрессии PD-L1
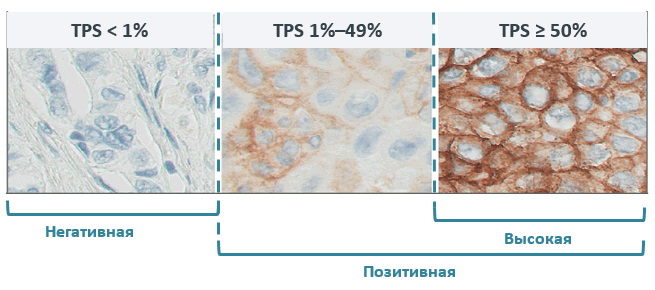
Экспрессия PD-L1 определяется методом иммуногистохимии. Оценка осуществляется путем подсчета соотношения опухолевых клеток с позитивным окрашиванием мембраны к общему количеству опухолевых клеток (TPS – tumor proportion score), результат выражается в процентах от 0 до 100.
В России зарегистрированы три диагностических набора для определения экспрессии PD-L1: производства Roche Diagnostics – PD-L1 sp142 и sp263, производства Dako – PD-L1 22C3. Тестирование проводится на платформах Ventana и Dako Autostainer Link 48 соответственно.
Экспрессия PD-L1 на опухолевых клетках
По уровню экспрессии PD-L1 выделяют следующие группы: отрицательная и позитивная экспрессия, в зависимости от количества окрашенных клеток.
Для тестирования может быть использован операционный или биопсийный материал первичной или метастатической опухоли, фиксированный в формалине и залитый в парафин. Обязательным требованием является наличие в исследуемом образце не менее 100 живых опухолевых клеток.
Определение уровня экспрессии PD-L1 и персонализированный подход к выбору терапии, основанный на результатах иммуногистохимического тестирования, позволяет сделать лечение пациентов с немелкоклеточным раком легкого более эффективным и безопасным в 1 линии терапии.
Алгоритм тестирования при распространенном НМРЛ
УРОТЕЛИАЛЬНЫЙ РАК: методы определения экспрессии PD-L1
Стандартом терапии 1 линии пациентов с раком уротелия продолжают быть химиотерапевтические режимы на основе цисплатина [4]. Однако по данным литературы до 50% больных не подходят для назначения данной терапии [5]. Ситуация с лечением изменилась с появлением иммунотерапевтических анти-PD-L1 препаратов [7]. Сейчас для назначения иммунотерапии в первой линии распространенного уротелиального рака пациентам, которые не могут перенести ципсплатин, рекомендовано проведение PD-L1 диагностики. Для остальных групп пациентов диагностика PD-L1 не требуется (при невозможности проведения любой платиносодержащей химиотерапии и у пациентов с прогрессированием заболевания в ходе или после окончания любой платиносодержащей химиотерапии или в течение 12 месяцев после неоадъювантной или адъювантной химиотерапии).
Какой метод используется для определения экспрессии PD-L1 у пациентов с уротелиальным раком?
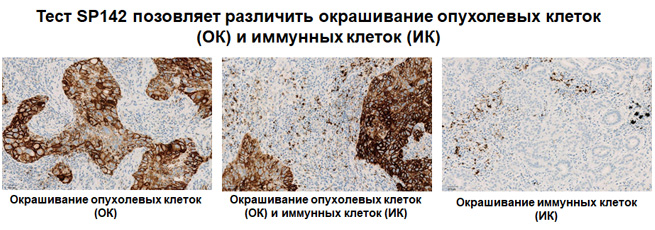
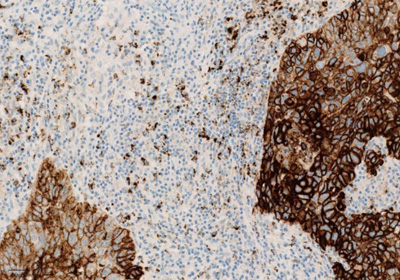
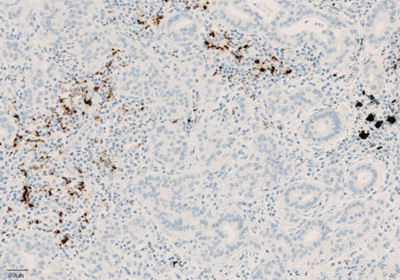
Экспрессия PD-L1 определяется методом иммуногистохимии. Для этих целей используется диагностический набор Ventana PD-L1 (SP142) Assay (Ventana Medical Systems, Inc.). Для тестирования используется ткань опухоли, фиксированная в формалине и залитая в парафиновый блок. PD-L1 статус у пациентов с уротелиальной карциномой определяется как часть площади опухоли, занятая PD-L1 экспрессирующими иммунными клетками, инфильтрирующими опухоль, любой интенсивности окрашивания.
Рисунок 3. Окрашивание опухолевых и иммунокомпетентных клеток, инфильтрирующих опухоль, с помощью ИГХ-анализа VENTANA PD-L1 (SP142).
Рисунок 4. Окрашивание иммунокомпетентных клеток, инфильтрирующих опухоль, с помощью ИГХ-анализа VENTANA PD-L1 (SP142).
Определение уровня экспрессии PD-L1 иммуногистохимическим методом позволяет выделить группу пациентов для назначения анти-PD-L1 терапии.
Какой уровень PD-L1 экспрессии является основанием для назначения иммуннотерапии при уротелиальном раке?
Наличие у пациентов экспрессии PD-L1 ≥5% на иммунокомпетентных клетках, инфильтрирующих ткань уротелиальной карциномы, по данным клинических исследований ассоциирована с увеличением частоты объективного ответа на иммунную терапию.
ТНРМЖ: методы определения экспрессии PD-L1
Тройной негативный рак молочной железы – самая агрессивная форма среди рака молочной железы [4]. Традиционно применяемая химиотерапия не позволяла достичь значимого увеличения продолжительности жизни свыше медианы в 18 месяцев. Появление анти-PD-L1 терапии, с одной стороны, позволило преодолеть медиану общей выживаемости в 2 года, а с другой стороны – для назначения терапии необходимо выделить группу PD-L1 позитивных пациентов. В отличие от уротелиального рака, назначение анти-PD-L1 терапии обязательно требует тестирования пациенток с тройным негативным раком молочной железы.
Какой метод используется для определения экспрессии PD-L1 у пациентов с ТНРМЖ?
При определении статуса PD-L1 для решения вопроса об иммунотерапии важно выбрать оптимальный метод. Тест VENTANA PD-L1 (SP142) позволяет идентифицировать пациентов с тройным негативным раком молочной железы (ТНРМЖ), которые могут получать анти-PD-L1 терпию.
Ткани пациентов с ТНРМЖ, окрашенные с использованием теста VENTANA PD-L1 (SP142), оценивают по окрашиванию инфильтрирующих опухоль иммунных клеток (IC). IC – это иммунные клетки, присутствующие в интратуморальной и прилегающей перитуморальной строме. В это понятие включены лимфоциты, макрофаги, дендритные клетки и полиморфноядерные лейкоциты. IC оценивают как долю области опухоли, которую занимают иммунные клетки с окрашиванием PD-L1 любой интенсивности.
Какой уровень PD-L1 экспрессии является основанием для назначения иммунной терапии при ТНРМЖ?
Наличие у пациентов экспрессии PD-L1 ≥1% на иммунокомпетентных клетках, инфильтрирующих ткань опухоли, по данным клинических исследований ассоциирована с увеличением общей выживаемости, выживаемости без прогрессирования и частоты объективного ответа на иммунную терапию.
О программе определения экспрессии PD-L1
- Тестирование в рамках программы проводится на всей территории страны.
- Отправка материала и тестирование проводятся бесплатно для врачей, лечебных учреждений и пациентов.
Список литературы:
- Zitvogel L, et al. Tumor Immunol. 2006; 6(10): 715-727. 2. Vesely MD, Schreiber RD. Ann NY Acad Sci. 2013; 1284(1): 1-5.
- May KF Jr, et al. In: Prendergast GC et al. Cancer Immunotherapy. 2nd ed. Elsevier; 2013: 101-113.
- Pardoll DM. Nat Rev Cancer. 2012; 12(4): 252-264. 2. McDermott DF, Atkins MB. Cancer Medicine. 2013; 2(5): 662-673.
- Garon EB, et al. N Engl J Med. 2015; 372(21): 2018-2028.
- Mino-Kenudson M. Programmed cell death ligand-1 (PD-L1) expression by immunohistochemistry: could it be predictive and/or prognostic in non-small cell lung cancer? Cancer Biol Med. 2016; 13: 157-170. doi: 10.20892/j.issn.2095-3941.2016.0009.
- Dako Denmark A/S. PD-L1 IHC 22C3 pharmDx™ Interpretation Manual. 2. Dako Denmark A/S. Immunohistochemical Staining Methods. Sixth Edition, 2013.
- Saleh K, Khalifeh-Saleh N, Kourie HR. Is it possible to rechallenge with PD-1/PD-L1 inhibitors after progression? Immunotherapy. Vol. 10(5), P.345-347.
- Ghiotto M, Gauthier L, Serriari N, et al. PD-L1 and PD-L2 differ in their molecular mechanisms of interaction with PD-1. Int Immunol. Vol. 22(8), P.651-660.
- Sharpe AH, Pauken KE. The diverse functions of the PD1 inhibitory pathway. Nat Rev Immunol. Vol. 18(3), P.153-167.
- Ratcliffe MJ, et al. Clin Cancer Res. 2017; 23(14): 3585-3581.
- von der Maase H, Sengelov L, Roberts JT, et al. Long-term survival results of a randomized trial comparing gemcitabine plus cisplatin, with methotrexate, vinblastine, doxorubicin, plus cisplatin in patients with bladder cancer. J Clin Oncol. Vol. 23(21), P.4602-4608.
- Hirsch FR, Bunn PA. Lancet Oncol. 2009; 10(5): 432-433.
- Kwak EL, et al. N Engl J Med. 2010; 363(18): 1693-1703.
- Sonpavde G, Galsky MD, Latini D. Cisplatin-ineligible and chemotherapy-ineligible patients should be the focus of new drug development in patients with advanced bladder cancer. Clin Genitourin Cancer. Vol. 12(2), P.71.
- Reck M, et al. N Engl J Med. 2016; 375(19): 1823-1833.
- Garon EB, et al. N Engl J Med. 2015; 372(21): 2018-2028.
- De Santis M, Bellmunt J, Mead G, et al. Randomized phase II/III trial assessing gemcitabine/carboplatin and methotrexate/carboplatin/vinblastine in patients with advanced urothelial cancer who are unfit for cisplatin-based chemotherapy: EORTC study 30986. J Clin Oncol. Vol. 30(2), P.191-199.
- Hirsch FR, et al. J Thoracic Oncol. 2017; 12(2): 208-222.
- Medical Systems Inc. VENTANA PD-L1 (SP142) Assay Interpretation Guide. pretation Guide. Реагент Ventana PD-L1 (SP142) IHC Assay для иммуногистохимической оценки лиганда-1 белка программируемой смерти в in vitro диагностике к иммуностейнерам автоматическим серии Ventana BenchMark №РЗН 2020 /9554 от 21.01.2020.
- Melosky B, Blais N, Cheema P, at al. Standardizing biomarker testing for Canadian patients with advanced lung cancer. Curr Oncol. 2018 Feb; 25(1): 73-82.
- Ratcliffe MJ, et al. Clin Cancer Res. 2017; 23(14): 3585–3581.
- Ilie M, et al. PLoSONE. 2017; 12(8): 1.
- Balar A.V., Dreicer R., Loriot Y. et al. Atezolizumab (atezo) in first-line cisplatin-ineligible or platinum-treated locally advanced or metastatic urothelial cancer (mUC): Long-term efficacy from phase 2 study IMvigor210. J Clin Oncol 36, 2018 (suppl; abstr 4523).
- Herbst RS et al. Lancet. 2016;387(10027):1540–1550.
Войти
в базу данных
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
в программе
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.